ラットES細胞
ラットは、マウスに比べ体が大きいので、血液や尿などの試料を経時的かつ、多量に採取しやすく、臓器移植などの外科的手術も容易に行えるという利点があり、ヒトの疾患モデル動物としては非常に有用で、古くから生理学、心理学、栄養学や臨床試験などの領域で多くのデータが蓄積されている。 しかし、マウスが1980年代に生殖系列に寄与するES細胞が樹立されて以来、ノックアウトにより遺伝子レベルでの機能解析が進む一方で、ラットのES細胞は長い間、樹立できず研究の領域が限られるようになった。 2008年にようやくマウスのES細胞が樹立されて、約30年の年月が流れて、生殖系列に寄与するラットES細胞が樹立された(Cell 2008 )。 当研究室においても、遺伝子操作後にも生殖系列に寄与するラットES細胞の樹立に成功した(図)。現在は、ノックアウトラットの作製や、マウス←ラットESの異種キメラを作製(Genes to Cells 2011 )して、異種細胞や異種臓器がどのように形成され、機能するのかどうかを解析している。
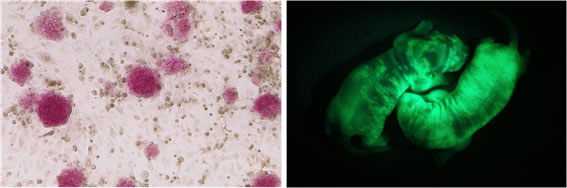
図 ALP陽性のラットES細胞(左)とGFP遺伝子を導入したラットESを用いたラットESキメラ(右)
ライブセルイージング
なぜ「ライブセル」なのか?
受精・初期発生に見られる一連のプロセスは時系列的に起きており、かつ多くの現象が原因と結果という関係で結ばれている。それらを「スナップショット」としてではなく、「動画」として捉える実験系が有用になることは容易に想像がつくだろう。さらに、観察後の胚を引き続き個体にまで培養・発生させることで、見られた現象と発生能を単一胚で直接結びつけることができる。例えば、体細胞クローンなど特殊な方法で構築された胚はヘテロな集団であり、それらの発生は必ずしも一様ではない。つまり、免疫染色によってある胚で何らかの違いが観察されても、それがその後の発生にどう影響するかは知り得ない。ライブセルイメージングではこの問題を解決できるはずである。以上から、われわれは単に現象を時系列的に観察するだけでなく、長時間観察でも発生に影響を与えないイメージング系を開発した。
イメージングの実際
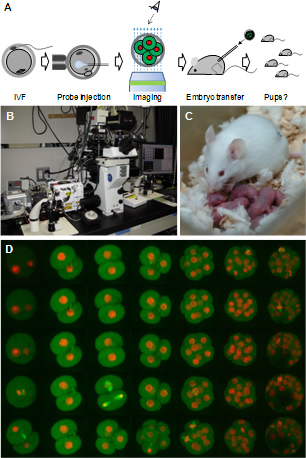
上記の目的を達するためには、培養条件を安定化し、光毒性を極力抑えることがカギとなる。そこで、われわれは顕微鏡システムの開発や観察条件の最適化を行った。パネルAはイメージングの流れを示している。未受精卵や受精卵に蛍光プローブ(RNAや蛍光試薬、蛍光ラベルされた目的タンパク質の抗体など)を適量インジェクションし、独自に開発した顕微鏡(パネルB)によりイメージングを行なう。蛍光融合タンパク質を発現する遺伝子組換え動物由来の卵子等も有用である。その後、必要に応じて胚を仮親に移植し、産仔の有無で発生能を検討する。パネルDはEGFP-α-tubulinとHistone H2B-mRFP1のRNAをインジェクションした胚のムービーの一例である。この胚は計6万回に及ぶレーザー照射を受けているが、移植後に問題なく産仔が得られた(パネルC)ことから、われわれの開発したイメージング技術が胚にやさしいものであることがわかる。
より簡単な遺伝子改変法の開発
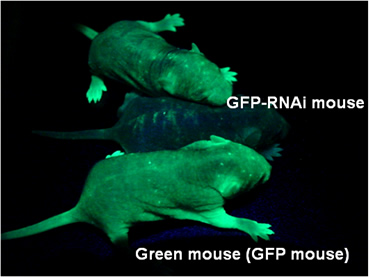
動物個体で遺伝子の機能を解析するために、遺伝子を欠損させたノックアウトマウス、遺伝子の発現を増加させたり異所的に発現させたトランスジェニックが一般的に用いられている。ノックアウトマウスはES細胞を用いて相同組換えを行い、そこで得られたESクローンからキメラマウスを作製するなど多くの時間を要するためにもっと簡単に短時間で遺伝子の機能を破壊する方法の開発が望まれている。我々は20塩基程度の短鎖RNA(siRNA)による遺伝子発現抑制法であるRNAiに着目し、siRNAを恒常的に発現するRNAiトランスジェニックマウスを作製し、その有効性を検討している。下の写真はその1例としてGFPを標的としたRNAiトランスジェニックマウスである。
研究の詳細については各ラボメンバーのHPにも記載されています。